A01-4-16
多段階発癌に於ける低酸素応答機構と癌抑制遺伝子のクロストークに迫るオミクス解析
- 研究代表者: 原田 浩(京都大学放射線生物研究センター 教授):
- 連携研究者: 吉村 通央(京都大学大学院医学研究科 助教)
- 連携研究者: 後藤 容子(京都大学大学院医学研究科 助教)
- 連携研究者: 小林 稔 (京都大学放射線生物研究センター 研究員)
- 連携研究者: 森鳰 章代(京都大学放射線生物研究センター 研究員)
研究室ホームページ http://radiotherapy.kuhp.kyoto-u.ac.jp/biology/
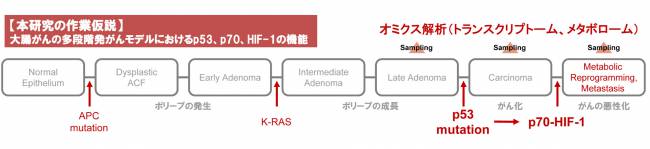
正常細胞ががん化する過程で、がん遺伝子やがん抑制遺伝子に徐々に変異が蓄積する多段階発がんモデルが提唱されています。その最終段階では、がん抑制遺伝子p53の機能が低下することでがんの悪性形質が誘導されると理解されていますが、詳細なメカニズムは解明されていません。本研究で私達は、独自に同定した新規遺伝子に着目してトランスクリプトーム・メタボローム解析を実施し、ここで機能する遺伝子ネットワークを解明します。
がん細胞の糖代謝経路リプログラミングや転移・浸潤能を誘導する遺伝子として低酸素誘導性因子1(HIF-1)が同定されていますが、我々は遺伝学的スクリーニング実験を通して、70kDaの遺伝子産物を新規HIF-1活性化因子として同定することに成功しています(遺伝子名の無い新規遺伝子ですので、便宜上p70と呼びます)。予備検討を通して私達は、1)大腸がんがp53の機能を失った場合にp70がHIF-1を活性化できるようになり、糖代謝経路のリプログラミングや転移・浸潤が誘導されることを発見しました。また、2)p70を遺伝子工学的に活性化した大腸がん細胞はp53 nullの場合に増殖能が高まること、さらに 3)p70発現量の高い大腸がん患者は生命予後が不良であることを見出しています。これらの予備的知見は、『大腸がんの多段階発がん過程に於いて、p53の機能が低下することを引き金にp70がHIF-1を活性化できるようになり、糖代謝のリプログラミングや転移・浸潤能といった悪性形質が誘導される』ことを強く示唆しています。そこで本研究で私達は、トランスクリプトームやメタボローム技術を活用して、ここで機能する遺伝子ネットワークの全容を体系的に捉え、正常組織と腫瘍組織の差異が生じる基本原理を理解し、創薬に繋がる礎を築くことを目指します。