-
-
-
- A01班
- A02班
A01-6-18
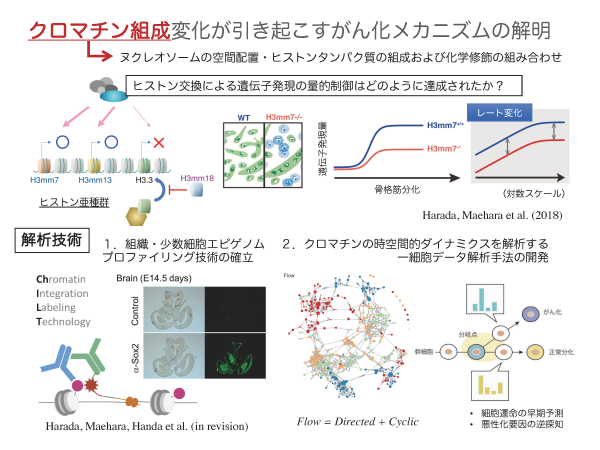
クロマチン組成変化が引き起こすがん化メカニズムの解明
- 研究代表者: 前原 一満(九州大学生体防御医学研究所 助教)
- 連携研究者: 大川 恭行(九州大学生体防御医学研究所 教授)
研究室ホームページ http://tx.bioreg.kyushu-u.ac.jp/
生体内では、ゲノム上に存在する数万もの遺伝子から必要な遺伝子が適切に選択されます。発がんは、この選択機構の破綻といえます。遺伝子発現調整システム破綻の本質を理解するには、転写のみならず、転写を誘導する過程であるクロマチン構造制御の解明が不可欠です。そこで私は、全ゲノムレベルで、ヒストンバリアント(亜種)の選択に始まり、ヒストン修飾からクロマチン高次構造変換に至る機序の解明を目指しています。これまでに、マウス・ヒトに存在する未知のヒストンH3亜種遺伝子を多数報告していました(Epigenetics & Chromatin, 2015)。昨年度は、ヒストン亜種H3mm7が、クロマチンへの取り込みによって、分化に伴う遺伝子発現量の「レート変化」を引き起こすことを発見し、これが骨格筋の分化や再生遅延を引き起こすクロマチンの仕組みのひとつであると考えられました(Nat. Comm., 2018)。一方、発がんに伴って、遺伝子全体が高発現状態になること(Hypertranscription)が知られており、遺伝子発現量のレートを制御するヒストンバリアントの機能解明が急務となっています。そこで本研究では、遺伝子発現量のレート変化機構の解明を目指します。これを実現するために、組織・少数細胞を対象としたトランスクリプトーム・エピゲノム計測技術の確立、および一細胞トランスクリプトーム・エピゲノムデータに内在する多層的な時間フローを抽出する情報解析手法を開発し、ヒストンバリアントが制御する細胞内の遺伝子発現量のレート変化による発がん機序の解明を行います。